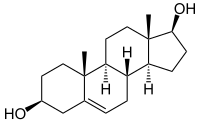
Androstendiol
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Androstendiol | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C19H30O2 | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 290,44 g·mol−1 | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Androstendiol, genauer 5-Androsten-3β,17β-diol oder Hermaphrodiol, ist ein biologisch aktives Steroid. Als Steroidhormon ist es eine chemische Zwischenstufe bei der Biosynthese von Testosteron aus Pregnenolon über Dehydroepiandrosteron (DHEA).
Biologische Bedeutung
[Bearbeiten | Quelltext bearbeiten]
Bei der Testosteronbiosynthese aus Pregnenolon werden zwei Synthesewege diskutiert, der Δ4-Stoffwechselweg über (Progesteron-Hydroxprogesteron-Androstendion) und der Δ5-Stoffwechselweg über (Hydroxypregnenolon-Dehydroepiandrosteron-Androstendiol).[3] Diese Vorgänge finden in den Leydig-Zellen der Hoden statt. Bei der Umwandlung von Androstendiol zu Testosteron wird die Hydroxlgruppe am C-3 zur Ketogruppe oxidiert.
Die Steroidhormone lassen sich durch Enzyme (Dehydrogenase oder Isomerase oder die P450-abhängigen Enzyme oder Aromatase) ineinander umwandeln. Charakteristisch für das männliche (androgene) Sexualhormon Testosteron ist, dass der A-Ring des Steroidgerüstes (Steran) nicht aromatisch ist. Es lässt sich unter Einwirkung des Enzyms Aromatase, das wiederum im Endoplasmatischen Retikulum (ER) der Nierenrinde erzeugt wird, aromatisieren und damit umwandeln in ein Estrogen.
Androstendiol bindet bei der Biosynthese an einen Estradiolrezeptor. Die Bindungsaffinität von Steroiden an ihre Rezeptoren wird vor allem durch das Vorhandensein von Keto- und Hydroxygruppen reguliert, daher spielen Oxidoreduktasen und 17β-Hydroxysteroid-Dehydrogenasen in der Steroidmodulation eine Rolle.[4] 5-Androstendiol ist ein direkter Metabolit des Steroids Dehydroepiandrosteron (DHEA), das in der menschlichen Hirnrinde produziert wird. Es ist weniger androgen als das 4-Androstendiol und man hat festgestellt, dass es das Immunsystem beeinflusst.[5] Androstendiol besitzt estrogene Wirkung, ähnlich wie DHEA.[6][7][8] Weil es die Produktion von weißen Blutkörperchen und Blutplasma induziert, lässt es sich als Indikator für ionisierende Strahlung (Neumune HE2100) verwenden.[9] Außerdem hat diese Zwischenstufe Bedeutung für die Entwicklung von Medikamenten gegen Prostatakrebs. Da nicht nur gesundes Prostatagewebe, sondern auch Prostatakarzinomzellen androgenabhängig sind, kann diese Krebserkrankung durch eine hormonelle Blockade oder Antiandrogene behandelt werden.[10] Es beeinflusst auch den Haarwuchs.[11]
Literatur
[Bearbeiten | Quelltext bearbeiten]- H. Lüllmann, K. Mohr, M. Wehling, L. Hein: Pharmakologie und Toxikologie. 18. Auflage, Thieme Verlag 2016, S. 476–478. ISBN 978-3-13-368518-4.
- Teresa Kołek et al.: Hydroxylation of DHEA, androstenediol and epiandrosterone by Mortierella isabellina AM212. Evidence indicating that both constitutive and inducible hydroxylases catalyze 7α- as well as 7β-hydroxylations of 5-ene substrates. In: Org. Biomol. Chem. 2011, 9, S. 5414. doi:10.1039/c1ob05350g.
- Cherkasov Artem et al.: An Updated Steroid Benchmark Set and Its Application in the Discovery of Novel Nanomolar Ligands of Sex Hormone-Binding Globulin. In: Journal of Medicinal Chemistry. 2008, doi:10.1021/jm7011485.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b Datenblatt 5-Androstene-3β,17β-diol bei Sigma-Aldrich, abgerufen am 26. August 2017 (PDF).
- ↑ Mikael Häggström, David Richfield: Diagram of the pathways of human steroidogenesis. In: WikiJournal of Medicine. Band 1, 2014, doi:10.15347/wjm/2014.005.
- ↑ G. Löffler, P. Petrides: Biochemie und Pathobiochemie. Springer Verlag, 2003, 7. Aufl., ISBN 3-540-42295-1, S. 891.
- ↑ D. Ganten, K. Ruckpul: Molekularmedizinische Grundlagen von Para- und autokrinen Regulationsstörungen. Springer Verlag, 2006, ISBN 978-3-540-28781-0, S. 547–549.
- ↑ D. S. Coffey: The Physiology of Reproduction. Hrsg.: E. Knobil, J. Neill. Raven Press, New York 1988, ISBN 978-0-88167-281-7, Kapitel Androgen action and the sex accessory tissues, S. 1081–1119.
- ↑ Reinhard Hackenberg, Inga Turgetto, Angelika Filmer, Klaus-Dieter Schulz: Estrogen and androgen receptor mediated stimulation and inhibition of proliferation by androst-5-ene-3β,17β-diol in human mammary cancer cells. In: The Journal of Steroid Biochemistry and Molecular Biology. 46. Jahrgang, Nr. 5, 1993, S. 597–603, doi:10.1016/0960-0760(93)90187-2.
- ↑ George G. J. M. Kuiper, Bo Carlsson, Kaj Grandien, Eva Enmark, Johan Häggblad, Stefan Nilsson, Jan-Åke Gustafsson: Comparison of the ligand binding specificity and transcript tissue distribution of estrogen receptors alpha and beta. In: Endocrinology. Band 138, Nr. 3, März 1997, S. 863–870, doi:10.1210/endo.138.3.4979, PMID 9048584.
- ↑ Rob Bradbury: Cancer. Springer Science & Business Media, 2007, ISBN 978-3-540-33120-9, S. 43 (google.com).
- ↑ M. H. Whitnall, T. B. Elliott, R. A. Harding, C. E. Inal, M. R. Landauer, C. L. Wilhelmsen, L. McKinney, V. L. Miner, W. E. Jackson 3rd, R. M. Loria, G. D. Ledney, T. M.: Androstenediol stimulates myelopoiesis and enhances resistance to infection in gamma-irradiated mice. In: International Journal of Immunopharmacology. Band 22, Nummer 1, Januar 2000, S. 1–14, PMID 10684984, doi:10.1016/s0192-0561(99)00059-4.
- ↑ Z. Culig, J. Stober, A. Gast, H. Peterziel, A. Hobisch, C. Radmayr, A. Hittmair, G. Bartsch, A. C. Cato, H. Klocker: Activation of two mutant androgen receptors from human prostatic carcinoma by adrenal androgens and metabolic derivatives of testosterone. In: Cancer detection and prevention. Band 20, Nummer 1, 1996, S. 68–75, PMID 8907206.
- ↑ F. Horn, G. Lindenmeier et al.: Biochemie des Menschen. Thieme Verlag 2002, S. 405, ISBN 3-13-130882-6.


